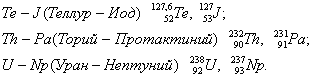Готовые домашние задания по химии к учебнику О. С. Габриелян "ХИМИЯ 8 класс"
§7
Ответ на вопрос 1(1).
Изотопы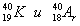 хотя и имеют, примерно одинаковую массу проявляют разные свойства, потому что их атомы обладают разными зарядами ядер и содержат разное количество электронов.
хотя и имеют, примерно одинаковую массу проявляют разные свойства, потому что их атомы обладают разными зарядами ядер и содержат разное количество электронов.
Ответ на вопрос 2(2).
Относительная атомная масса аргона близка к 40, т.к. в ядре его атома 18 протонов и 22 нейтрона, что больше чем в ядре атома калия -19 протонов и 20 нейтронов, поэтому относительная атомная масса калия и близка к 39. Так как число протонов в ядре атома калия больше, он стоит в таблице после аргона.
Ответ на вопрос 3(3).
Изотопы это разновидности атомов одного элемента, имеющие одинаковое количество протонов и электронов, но различное число нейтронов
Ответ на вопрос 4(4).
Изотопы хлора схожи по свойствам, потому что свойства элементов определяются зарядом ядра, а не его относительной атомной массой. Даже при изменении относительной атомной массы изотопов хлора на 1 иди 2 единицы масса изменяется незначительно, в отличие от изотопов водорода, где при добавлении одного или двух нейтронов масса ядра изменяется в 2 или даже в З раза.
Ответ на вопрос 5(5).
Дейтериевая (тяжелая вода) — соединение, где 1 атом кислорода связан с двумя атомами изотопа водорода 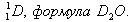
«Сравнение свойств лёгкой и тяжёлой воды»
Тяжёлая вода имеет молекулярную массу равную 20, а обычная вода – 18, поэтому плотность тяжёлой воды равна 1,105г/мл, а обычной воды – 1,005г/мл. Температура кипения обычной воды 100 0С, а тяжёлая вода закипает при 101,43 0С. Обычная вода начинает замерзать около нуля градусов, а тяжёлая вода при 3,81 градусов тепла.
Максимальную плотность обычная вода приобретает при 4 градусах тепла, а тяжёлая вода – при 11,6. Один литр газообразной обычной воды весит примерно 0,803г/л, а тяжёлой воды – 0,893г/л.
Обычная вода является основным веществом для нормальной жизнедеятельности организмов, населяющих планету Земля, а тяжёлая вода губительна для всего живого.
Вначале расположен элемент с большим значением относительной атомной массы в парах: