Готовые домашние задания по химии к учебнику О. С. Габриелян "ХИМИЯ 8 класс"
Практическая работа № 6(8). «Ионные реакции»
Опыт 1. «Обнаружение сульфат-ионов SO42– ».
Выполнение работы:
В одну пробирку налили раствор сульфата натрия, в другую — раствор сульфата калия и прибавили в каждую раствор хлорида бария. В обеих пробирках выпал белый мелкокристаллический осадок:
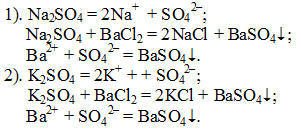
Для обнаружения ионов бария можно воспользоваться следующими реактивами:
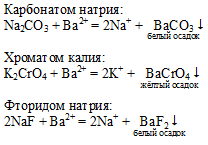
Сущность обнаружения ионов с помощью реактива заключается в специфичности некоторых реакций, когда они сопровождаются различными аналитическими сигналами: выделением газа или выпадением осадка определенного цвета.
Опыт 2. «Обнаружение хлорид-ионов Cl–»
Выполнение работы:
Нерастворимые хлориды серебра и свинца. Присутствие ионов Cl– в растворе хлорида натрия можно доказать при помощи нитрата серебра:
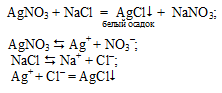
образуется белый творожистый осадок.
Опыт З «Обнаружение сульфат ионов SO42– и хлорид ионов Cl–»
Выполнение работы:
Для обнаружения в пробирках хлорида калия и сульфата магния воспользуемся следующим планом:
Раствор из одной пробирки отлили в другую пробирку так, чтобы в каждой было примерно одинаковое количество раствора. В одну пробирку прильем немного раствора нитрата свинца (II), в другую раствор хлорида бария. Смотрим, в какой из пробирок выпал осадок, если в одной, то значит, здесь был раствор хлорида калия, если в двух — сульфат магния.
В пробирку, где быв второй исходный раствор, прильем немного раствора нитрата свинца и убедимся в правильности наших рассуждений, что если тогда выпали осадки ВаSO4 и РbSO4 и в пробирке находится MgSO4, то сейчас вsgал осадок PbCl2 и в этой пробирке находится КСl. Или наоборот. Тогда выпал осадок РbCl2, а сейчас выпал осадок РbSO4.
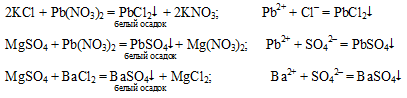
Опыт 4.
Выполнение работы:
а) Проделаем реакции, подтверждающие качественный состав ВаCl2. Раствор из пробирки разделим пополам и перельем в 2 пробирки.
Докажем присутствие ионов Ва2+ — прильем в одну пробирку разбавленную серную кислоту, выпадает белый осадок:
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Докажем присутствие ионов Cl– — прильем в другую пробирку раствор нитрата серебра, выпадет белый осадок:
BaCl2 + 2AgNO3 = 2AgCl↓ + Ba(NO3)2
б) Проделаем реакции, подтверждающие качественный состав MgSO4.
Раствор из пробирки разделим пополам и перельем в 2 пробирки.
Докажем присутствие ионов Mg2+ — прильем в одну пробирку раствор NаОН, выпадает белый осадок:
MgSO4 + 2NaOH = Na2SO4 + Mg(OH)2↓
Докажем присутствие нонов SO22–— прильем в другую пробирку раствор хлорида бария, выпадет белый осадок:
MgSO4 + BaCl2 = BaSO4↓ + MgCl2
в) Проведем реакции, подтверждающие качественный состав (NH4)2CO3. Раствор из пробирки разделим пополам и перельем в две пробирки. Докажем присутствие ионов NH4+ прильем в пробирку раствор NаОН, почувствуем запах аммиака:
(NH4)2CO3 + 2 NаОН = Na2CO3 + 2NH3↑ + 2H2O
Докажем присутствие ионов СО3– — прильем в пробирку раствор НСl, будет выделяться газ:
(NH4)2CO3 + 2HCl = 2NH4Cl + CO2↑ + H2O