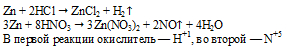Готовые домашние задания по химии к учебнику О. С. Габриелян "ХИМИЯ 8 класс"
§43 (43). Окислительно-восстановительные реакции
Ответ на вопрос 1(1).
К окислительно-восстановительным реакциям относятся:
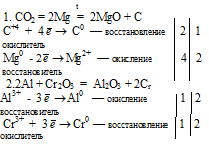
Ответ на вопрос 2 (2).
Реакция синтеза аммиака:
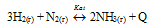
является: прямой, соединения, каталитической, экзотермической, обратимой, протекает в газовой фазе, окислнтельно-восстановительной
Ответ на вопрос 3 (3).
а) Утверждение неверно, т.к. существуют реакции ионного обмена, в которых не происходит окислительно-восстановительных процессов, например,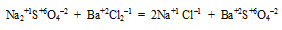
б) Утверждение верно, т.к. во всех реакциях ионного обмена не происходит окислительно-восстановительный процесс, например,
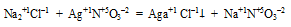
в) Утверждение верно, т.к. во всех реакциях замещения участвует простое вещество, которое меняет свою степень окисления от 0 до некоторого значения, например,
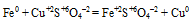
г) Утверждение неверно, т.к. все реакции замещения являются окислительно-восстановительными:
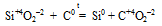
д) Утверждение верно т.к., если в результате реакции образовалось простое вещество, то до этого данный элемент входил в состав сложного вещества и имел степень окисления, отличную от нуля, т.е. степень окисления изменяется:
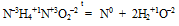
е) Утверждение неверно, т.к. существуют реакции соединения и разложения, которые являются окислительно-восстановительными:
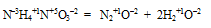
Ответ на вопрос 4 (4).
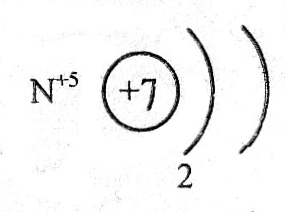 HN+5O3 проявляет только окислительно-восстановительные свойства, тк. азот в данном соединении проявляет максимальную положительную степень окисления +5 и увеличивает ее, т.е. еще больше окислиться, не может.
HN+5O3 проявляет только окислительно-восстановительные свойства, тк. азот в данном соединении проявляет максимальную положительную степень окисления +5 и увеличивает ее, т.е. еще больше окислиться, не может.
Электронная формула азота в азотной кислоте будет иметь вид +7N+5 1s22s02p0, поэтому отдать оставшиеся 2 электрона на первом энергетическом уровне атому азота энергетически невыгодно.
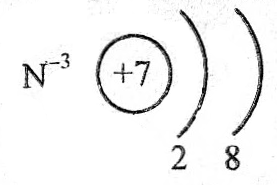 N–3H3 проявляет только восстановительные свойства, тк. азот в данном соединении проявляет максимально отрицательную степень окисления (-3) и ее уменьшить, те. еще больше восстановиться, не может.
N–3H3 проявляет только восстановительные свойства, тк. азот в данном соединении проявляет максимально отрицательную степень окисления (-3) и ее уменьшить, те. еще больше восстановиться, не может.
Электронная формула азота в аммиаке будет иметь вид +7N+5 1s22s22p6, т.е. все энергетические уровни атома заполнены, поэтому атом азота не может больше принять электронов.
Ответ на вопрос 5 (5).
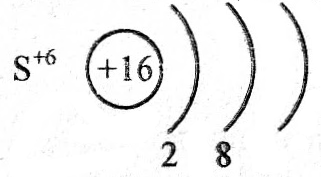 Н2S+6O4 проявляет только окислительные свойства, т.к. сера в данном соединении проявляет максимально положительную степень окисления +6 и увеличить ее,
т.е. еще больше окислить, не может.
Н2S+6O4 проявляет только окислительные свойства, т.к. сера в данном соединении проявляет максимально положительную степень окисления +6 и увеличить ее,
т.е. еще больше окислить, не может.
Электронная формула серы в серной кислоте будет иметь вид +16S+6 1s22s22p63s3p0, поэтому отдавать электроны с последнего энергетического уровня атом серы не может, так как их там просто нет, а отдача электронов с предпоследнего энергетического уровня энергетически невыгодна.
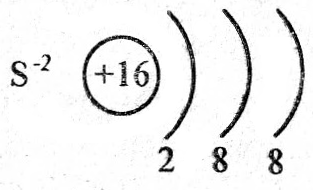 H2S–2 проявляет только восстановительные свойства. т.к. сера в данном соединении проявляет максимально отрицательную степень окисления –2 и ее уменьшить, т.е. еще больше восстановиться, не может.
H2S–2 проявляет только восстановительные свойства. т.к. сера в данном соединении проявляет максимально отрицательную степень окисления –2 и ее уменьшить, т.е. еще больше восстановиться, не может.
Электронная формула серы в сероводороде будет иметь вид +16S–2 1s22s22p63s23p6, т.е. все энергетические уровни атома заполнены, поэтому атом серы не может больше принять электронов.
Ответ на вопрос 6 (6).
SO2 может быть как восстановителем, так и окислителем, т.к. сера в данном соединении имеет степень окисления +4, а может иметь –2, 0, +1 +2 и +6, т.е. будет как окисляться, так и восстанавливаться.
Ответ на вопрос 7 (7).
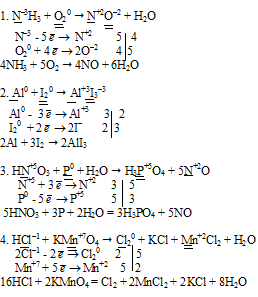
Ответ на вопрос 8 (8).