Готовые домашние задания по химии к учебнику О. С. Габриелян "ХИМИЯ 8 класс"
§33(с) Химическое равновесие и способы его смещения
Ответ на вопрос 1(с).
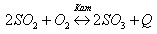
а) Реагенты: SO2 – сложное вещество, О2 – простое. Продукты: SO3 – сложное вещество.
б) SO2, O2 – газы; SO3 – жидкость;
в) направление – прямое;
г) присутствует катализатор;
д) тепло выделяется.
Чтобы сместить равновесие вправо, необходимо увеличить концентрацию SO2 и O2 и уменьшить концентрацию SO3; повысить давление, понизить температуру.
Ответ на вопрос 2(с).
Реакцию проводят при высокой температуре для того, чтобы увеличить ее скорость
Ответ на вопрос 3(с).
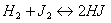
Чтобы сместить равновесие вправо, необходимо увеличить концентрацию H2 и J2 и уменьшить концентрацию HJ; повысить температуру.
Ответ на вопрос 4(с).
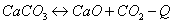
Чтобы сместить равновесие вправо, необходимо повысить температуру и понизить давление.
Ответ на вопрос 5(с).
Раствор угольной кислоты, окрашенный лакмусом в красный цвет со, временем становится фиолетовым, потому что H2CO3 — слабая, непрочная кислота и с течением времени разлагается на исходные вещества:
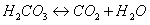
и в растворе остается только вода, которая имеет нейтральную среду, потому что углекислый газ улетучивается.
Ответ на вопрос 6(с).
Изменение давления не влияет на равновесие в системе:
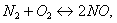
потому что общий объем исходных газов H2 и O2 равен объему продукта H2O. Т.к. процесс является эндотермическим, то при повышении температуры равновесие сместится вправо.