Готовые домашние задания по химии к учебнику О. С. Габриелян "ХИМИЯ 8 класс"
§10
Ответ на вопрос 1(1).
Электронная схема образования двухатомной молекулы галогена будет выглядеть следующим образом: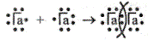
Общая структурная формула галогенов будет иметь вид:
НаI—НаI
Ответ на вопрос 2(2).
а) Схема образования химической связи для KCl:
Калий — элемент 1 группы, его атому легче отдать 1 внешний электрон, чем принять недостающие 7 электронов.
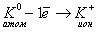
2. Кислород — неметалл, элемент главной подгруппы VI группы. Его атому легче принять 2 электрона, которых не хватает до завершения внешнего уровня, чем отдать 6 электронов с внешнего уровня:
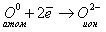
Хлор — элемент VII группы, его атому легче принять 1 недостающий электрон, чем отдать 7 электронов.
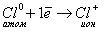
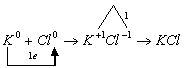
б) Схема образования химической связи для Cl2:
Хлор — элемент главной подгруппы VII группы. Его атомы имеют 7 электронов на внешнем уровне. Число непарных электронов равно (8-7)1.
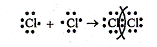
Связь между атомами одного и того же элемента ковалентная.
Ответ на вопрос 3(3).
Сера — элемент главной подгруппы VI группы. Ее атомы имеют 6 электронов на внешнем уровне. Число непарных электронов равно 2(8—6). В молекулах S2 атомы связаны двумя общими электронными парами, поэтому связь двойная ковалентная.
Схема образования молекулы S2 будет выглядеть следующим образом:

или
S=S
Ответ на вопрос 4(4).
В молекуле S2 связь двойная, в молекуле Cl2 связь одинарная, в молекуле N2 — тройная, поэтому самой прочной молекулой будет N2, менее прочной S2, а еще слабее Cl2.
Длина связи самая маленькая в молекуле N2, больше в молекуле S2, еще больше в молекуле Cl2.
Ответ на вопрос 5(5).
Вещества с ковалентной неполярной связью: N2, O2, H2.
Вещества с ионной связью: Li2O, KCl, CaF2.